肿瘤的耐药机制研究进展是当前肿瘤治疗领域的重要研究方向,耐药性是导致化疗、靶向治疗、免疫治疗等多种肿瘤治疗手段失败的关键原因,近年来,随着分子生物学、基因组学、蛋白质组学等技术的快速发展,对肿瘤耐药机制的认识不断深入,为克服耐药提供了新的思路和靶点。
肿瘤耐药性可分为固有耐药(又称原发性耐药)和获得性耐药(又称继发性耐药),固有耐药是指肿瘤细胞在接触治疗前就已存在的耐药特性,而获得性耐药则是指肿瘤细胞在治疗过程中逐渐产生的耐药能力,耐药机制复杂多样,涉及多个层面和多个因素的相互作用。
从分子机制来看,肿瘤耐药主要包括以下几个方面:药物靶点基因的突变或扩增是导致靶向治疗耐药的重要原因,表皮生长因子受体(EGFR)突变非小细胞肺癌患者使用EGFR酪氨酸激酶抑制剂(TKI)治疗后,常出现EGFR T790M突变,导致药物结合能力下降;间变性淋巴瘤激酶(ALK)融合阳性患者使用一代ALK-TKI后,可出现ALK L1196M、G1202R等耐药突变,药物外排泵的过度表达是导致多药耐药(MDR)的经典机制,ATP结合盒(ABC)转运蛋白家族成员如P-糖蛋白(P-gp)、多药耐药相关蛋白1(MRP1)等,能够将细胞内药物泵出细胞外,降低细胞内药物浓度,从而产生耐药性,第三,药物代谢酶的改变也会影响耐药性,细胞色素P450酶系中某些亚型的表达升高或活性增强,可加速药物的代谢失活;而谷胱甘肽S-转移酶(GST)等解毒酶的过度表达,则可增强细胞对药物的解毒能力,第四,DNA损伤修复能力的增强是导致化疗耐药的重要机制,肿瘤细胞通过上调DNA修复相关基因(如BRCA1/2、PARP等)的表达,增强对化疗药物(如铂类药物)诱导的DNA损伤的修复能力,从而逃避药物的杀伤作用,第五,肿瘤微环境的改变在耐药中发挥重要作用,肿瘤相关成纤维细胞(CAFs)、肿瘤相关巨噬细胞(TAMs)等基质细胞可通过分泌细胞因子(如IL-6、TGF-β等)、生长因子(如HGF、EGF等)以及提供代谢支持等方式,促进肿瘤细胞存活、增殖和耐药,缺氧、酸性等微环境特征也可通过激活缺氧诱导因子(HIF)等信号通路,促进肿瘤细胞适应不良微环境并产生耐药。
近年来,表观遗传学调控在肿瘤耐药中的作用受到广泛关注,DNA甲基化、组蛋白修饰、非编码RNA(如miRNA、lncRNA)等表观遗传学改变可通过调控耐药相关基因的表达,参与肿瘤耐药的发生发展,miR-21、miR-155等miRNA的过表达可抑制抑癌基因或促凋亡基因的表达,从而促进耐药;而某些lncRNA可通过作为竞争性内源RNA(ceRNA)吸附miRNA,解除miRNA对靶基因的抑制作用,进而调控耐药性。
肿瘤干细胞(CSCs)被认为是导致肿瘤复发和耐药的“种子”细胞,CSCs具有自我更新、多向分化能力以及较强的DNA修复、药物外排和抗凋亡能力,能够逃避常规治疗的杀伤,研究表明,多种信号通路(如Wnt/β-catenin、Hedgehog、Notch等)参与CSCs的干性维持,这些通路的异常激活与肿瘤耐药密切相关。
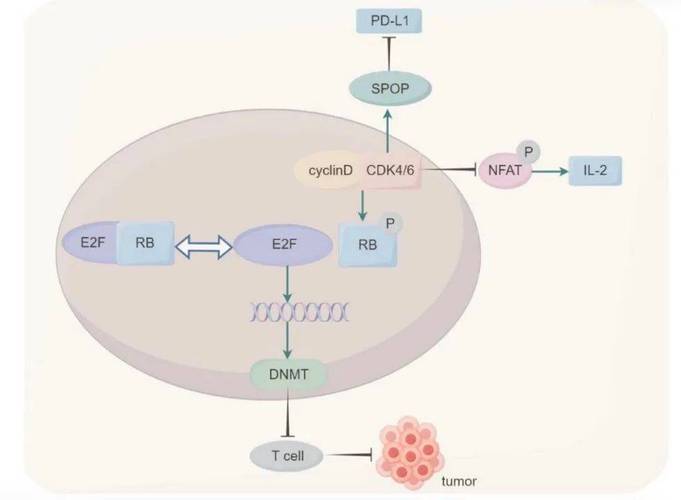
免疫治疗耐药机制也日益受到重视,免疫检查点抑制剂(如PD-1/PD-L1抑制剂、CTLA-4抑制剂)的耐药机制包括:肿瘤细胞抗原呈递缺陷(如MHC-I类分子表达下调)、免疫检查点分子表达上调(如PD-L2、TIM-3、LAG-3等)、肿瘤微环境中免疫抑制性细胞(如Tregs、MDSCs)浸润增加、以及免疫编辑导致免疫原性降低等。
为克服肿瘤耐药,研究者们提出了多种策略,包括:开发针对耐药突变的新型抑制剂(如第三代EGFR-TKI奥希替尼用于治疗EGFR T790M突变阳性患者);联合使用药物外排泵抑制剂(如维拉帕米)逆转多药耐药;利用表观遗传学药物(如DNA甲基化抑制剂、组蛋白去乙酰化酶抑制剂)调节耐药基因表达;针对肿瘤微环境的靶向治疗(如CAFs抑制剂、TAMs极化调节剂);以及通过免疫原性死亡诱导剂、联合免疫检查点抑制剂等策略增强抗肿瘤免疫应答等,基于液体活检(如循环肿瘤DNA、循环肿瘤细胞)的动态耐药监测,有助于早期发现耐药并指导个体化治疗调整。
肿瘤耐药主要机制及应对策略简表
| 耐药机制类型 | 具体机制描述 | 可能的应对策略 |
|---|---|---|
| 靶点改变 | 基因突变、扩增或缺失导致药物结合位点改变或信号通路绕过 | 开发新一代靶向药物、联合靶向不同节点的药物 |
| 药物外排泵过度表达 | ABC转运蛋白(如P-gp)将药物泵出细胞,降低胞内药物浓度 | 联合使用外排泵抑制剂(如第3代P-gp抑制剂) |
| DNA损伤修复增强 | 上调DNA修复相关基因(如BRCA1/2、PARP),修复化疗或靶向药物诱导的DNA损伤 | 联合使用DNA损伤修复抑制剂(如PARP抑制剂,用于BRCA突变肿瘤) |
| 肿瘤微环境作用 | CAFs、TAMs等基质细胞分泌因子支持肿瘤生存;缺氧、酸性微环境促进耐药 | 靶向基质细胞、调节微环境(如抗血管生成药物、改善缺氧)、联合免疫治疗 |
| 肿瘤干细胞特性 | CSCs具有自我更新、强抗凋亡和DNA修复能力,可逃避治疗 | 靶向CSCs特异性信号通路(如Wnt、Hedgehog)、诱导CSCs分化 |
| 表观遗传学改变 | DNA甲基化、组蛋白修饰、非编码RNA调控耐药基因表达 | 使用表观遗传学药物(如DNMT抑制剂、HDAC抑制剂)逆转耐药表型 |
| 免疫逃逸 | 肿瘤抗原呈递缺陷、免疫检查点分子上调、免疫抑制性细胞浸润 | 联合不同免疫检查点抑制剂、联合免疫治疗与放化疗/靶向治疗、肿瘤疫苗 |
相关问答FAQs
问题1:如何早期监测肿瘤耐药的发生?
解答:早期监测肿瘤耐药对于及时调整治疗方案至关重要,目前常用的方法包括:①液体活检:通过检测外周血中的循环肿瘤DNA(ctDNA)、循环肿瘤细胞(CTC)或外泌体中的耐药相关基因突变(如EGFR T790M、ALK耐药突变等),可实现无创、动态的耐药监测,比影像学更早发现耐药迹象;②影像学检查:如CT、MRI、PET-CT等,通过肿瘤大小、代谢活性等变化评估疗效,当出现疾病进展时提示可能耐药;③肿瘤标志物检测:部分肿瘤(如结直肠癌的CEA、肺癌的NSE等)的肿瘤标志物水平升高可能预示耐药或复发;④组织活检:在病情进展时,通过再次活检获取肿瘤组织,进行基因测序、蛋白质组学等分析,明确耐药机制,综合多种方法可提高耐药监测的敏感性和准确性。
问题2:克服肿瘤耐药的研究方向有哪些新趋势?
解答:克服肿瘤耐药的研究趋势主要体现在以下几个方面:①个体化精准治疗:基于患者肿瘤的基因组学、转录组学等分子特征,以及耐药机制检测结果,制定个体化的治疗方案,如针对特定耐药突变选择相应的靶向药物;②联合治疗策略:通过联合不同作用机制的药物(如靶向药物与免疫治疗联合、化疗与靶向治疗联合、不同靶向药物联合等),阻断耐药产生的多个环节,延缓或逆转耐药;③新型药物研发:开发针对耐药突变的新型抑制剂(如克服EGFR C797S突变的第四代TKI)、PROTACs(蛋白降解靶向嵌合体)降解耐药蛋白、抗体药物偶联物(ADC)等;④肿瘤微环境调控:靶向CAFs、TAMs、血管生成等微环境组分,改善免疫抑制性微环境,增强治疗效果;⑤免疫治疗优化:探索新的免疫检查点靶点、联合免疫调节剂(如细胞因子、肿瘤疫苗)、以及CAR-T细胞疗法在耐药肿瘤中的应用,通过增强抗肿瘤免疫应答克服耐药,这些趋势旨在从多维度、多靶点入手,为解决肿瘤耐药问题提供新的突破口。